Трансплантация
костного мозга и иммуносупрессивная терапия при
лечении больных апластической анемией
А.А.Ганапиев1,
К.М.Абдулкадыров2, А.Цандер3, Б.В.Афанасьев1
1Государственный медицинский университет
им. акад. И.П.Павлова,
2НИИ гематологии и трансфузиологии МЗ РФ,
Санкт-Петербург, Россия
3Университет, Гамбург, Германия
Апластическая анемия
(АА) относится к тяжелым заболеваниям системы
крови и характеризуется недостаточностью
кроветворения в костном мозге по трем линиям
гемопоэза с развитием панцитопении без
признаков опухолевого процесса (Josten K.M. et al., 1991).
Согласно современным представлениям, в основе
заболевания лежат 3 патофизиологических
механизма: аномалии стволовой клетки, нарушение
межклеточного взаимодействия и, в меньшей
степени,— дефект стромы костного мозга (Lougran T.P. et
al., 1990). Поэтому целесообразны следующие основные
подходы в терапии АА: 1) восстановление
нарушенных функций стволовой клетки пациента
путем трансплантации костного мозга (ТКМ) на
нормальную донорскую и 2) изменение
деструктивных иммунологических процессов с
помощью иммуносупрессивных (иммуномодулирующих)
препаратов.
ТКМ от HLA-идентичных
сиблингов — метод выбора у больных тяжелой АА (ТАА)
[1–2]. Абсолютным показанием к ТКМ является
сверхтяжелая АА (сТАА) с числом гранулоцитов
менее 0,2 ± 109/л, относительным — ТАА с числом
гранулоцитов менее 0,5 ± 109/л у пациентов в
возрасте 20–40 лет [3]. Установлено, что частота
реакций отторжения «трансплантат—против—хозяина»
и, в конечном итоге, результативность ТКМ при ТАА,
как и при других гематологических заболеваниях,
прежде всего зависят от длительности
трансфузиологического анамнеза (число гемо-трансфузий
до ТКМ) и режимов кондиционирования. В
соответствии с данными Storb R. и соавт. (1980), у
больных АА, имеющих HLA-идентичного донора
костного мозга с коротким трансфузиологическим
анамнезом (менее 10 гемотрансфузий), вероятность 5-летней
выживаемости составляет 90%. Частота отторжений
трансплантата у больных с совместимым костным
мозгом пропорциональна числу
предтрансплантационных трансфузий (Champlin R.E. et al.,
1989). В результате дополнения
предтрансплантационных протоколов
кондиционирования антитимоцитарным глобулином (АТГ)
3-летняя выживаемость больных ТАА составила
свыше 90% [2, 4].
У больных АА, старше 40–45
лет, не имеющих HLA-совместимого донора,
предпочтительна иммуносупрессивная терапия (ИсТ),
в основе которой — применение
антилимфоцитарного глобулина (АЛГ) и
циклоспорина А (ЦсА). Эффективность
использования АЛГ как отдельно, так и в сочетании
с другими препаратами, по данным многих
клинических исследований, составляет 40–75% [5].
Установлено также, что ЦсА может с успехом
применяться при лечении больных АА с АЛГ [1, 6].
Цель настоящего
исследования — оценка эффективности ТКМ у
больных, в режим кондиционирования которых был
включен АЛГ, а также определение эффективности
иммуносупрессивной терапии у пациентов, не
имеющих HLA-совместимого донора костного мозга. В
исследование были включены 151 больной с тяжелой (ТАА)
и нетяжелой (НАА) формами АА: у 16 — проведена ТКМ,
а у 135 — использованы АЛГ и ЦсА.
Трансплантация
костного мозга
ТКМ проводилась в
отделении трансплантации костного мозга
Медицинского университета Эппендорф г. Гамбурга
(Германия) в 1990–1998 гг. У большинства больных ТАА
посттрансплантационный период протекал
достаточно благоприятно. Из 16 больных, которым
была выполнена ТКМ от HLA-совместимого донора, к
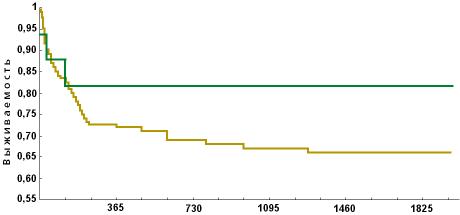
настоящему времени живы 13 (81,25%) (рисунок). Медиана
приживления трансплантата составила 18 дней [6].
Рисунок. Общая 5-летняя
выживаемость больных ТАА после ТАКМ и АА после
терапии АЛГ
У 3 больных
наблюдалась острая реакция «трансплантат—против—хозяина»
I степени и у 1 пациента — II степени, которая
купировалась кортикостероидными гормонами (метилпреднизолон,
урбазон). Еще у 2 больных через 4 и 6 мес после ТКМ
слабо проявлялась хроническая реакция «трансплантат—против—хозяина».
У 2 больных были
предприняты повторные ТКМ, так как в течение 3 нед
трансплантат донорского костного мозга не
приживался.
У 2 больных
определено развитие аспергиллеза. В одном случае,
несмотря на проводимую терапию, больной умер на
+22 сутки в результате грибкового сепсиса. В
другом — вследствие активной противогрибковой
терапии, а также оперативных мероприятий,
включая спленэктомию и удаление сегмента левого
легкого, пациент остался жив, и в настоящее время
достигнуто полное приживление донорского
костного мозга.
В раннем
посттрансплантационном периоде у 4 больных имел
место токсический мукозит I– III степени; у 1
больного обнаруживались токсический гепатит и
нефропатия. Из числа инфекционных осложнений — у
3 больных отмечена лихорадка неясного генеза и у 1
больного определялась пневмония. Еще у 2 больных
наблюдался катетерный сепсис. У всех была
эффективна терапия антибиотиками.
Достоверная разница
в эффективности ТКМ у 9 больных, которым
проведено менее 10 гемотрансфузий, в сравнении с 7
пациентами, получившими более 10 трансфузий
компонентов крови в предтрансплантационнном
периоде, отсутствовала. Это свидетельствует о
том, что режим кондици-онирования с АЛГ
обеспечивает достаточное иммуносупрессивное
действие и увеличивает эффективность ТКМ у
больных АА с длительным трансфузионным
анамнезом в предтрансплантационном периоде.
Антилимфоцитарный
глобулин (Антилимфолин)
В РосНИИ гематологии
и трансфузиологии МЗ РФ был разработан и с 1980 по
1997 г. проходил клинические испытания препарат
АЛГ — Антилимфомин (кроличьего или козьего
происхождения). В исследованиях участвовали 119
больных АА, не имевших HLA-идентичного донора
костного мозга (59 мужчин и 60 женщин в возрасте от
12 до 75 лет). Нетяжелую форму АА (НАА) имели 59
пациентов, тяжелую (ТАА) — 60, из них 15 —
сверхтяжелую (сТАА). После предварительной пробы
на совместимость препарат вводили в течение 3–18
ч. Малые дозы АЛГ (1–5 мг/кг веса больного)
использовали в количестве 8 введений на курс
лечения (384–1920 мг), тогда как большие дозы (10–30 мг/кг
веса больного) — 4–6 введений на курс (1920–7680 мг).
Результаты лечения
оценивались после каждого курса терапии АЛГ
отдельно среди больных с НАА и ТАА (сТАА). После 1
курса терапии АЛГ в группе НАА (59 чел.) полная
ремиссия была получена у 3 больных (5,1%), частичная
— у 26 (44,1%), клиническое улучшение — у 27 (45,8%) и
отсутствие эффекта установлено у 3 пациентов (5,1%).
Причем стойкий эффект на терапию среди больных,
которые достигли частичной ремиссии (свыше 3 мес),
был получен у 24 (92,3%) больных, тогда как среди
пациентов с клиническим улучшением — 17 (63%), и
соответственно у 2 (7,7%) и 10 (37%) пациентов ответ был
нестойким, что потребовало проведения
кортикостероидной терапии и(или) повторных
курсов АЛГ.
Из числа больных ТАА
(60 чел.) в результате лечения АЛГ полная ремиссия
достигнута у 2 больных (3,3%), частичная — у 7 (11,7%),
клиническое улучшение — у 39 (65%) и отсутствие
эффекта — у 12 пациентов (20%). Учитывая, что в целом
ответ на терапию после 1 курса АЛГ был достигнут у
56 больных НАА (94,9%) и у 48 больных ТАА (80%), повторные
курсы терапии были проведены 9 пациентам с НАА и 16
— с ТАА.
В результате
проведенной терапии среди больных НАА у 1 —
достигнута полная ремиссия, у 3 — частичная, у 4 —
клиническое улучшение и эффект отсутствовал у 1
пациента. Среди больных ТАА у 1— получена полная
ремиссия (6,3%), у 2 — частичная (12,5%), у 8 пациентов —
клиническое улучшение (50%) и у 5 — эффект
отсутствовал (31,2%). Таким образом, после
проведения 2 курсов АЛГ (при неэффективности или
малоэффективности 1-го курса) у 8 больных НАА (88,9%)
и у 11 больных ТАА (68,8%) был получен клинический
ответ. Такие результаты были расценены нами как
обнадеживающие. Поэтому 3 больным с НАА и 5 — с ТАА,
при неэффективности первых двух был предпринят 3-й
курс АЛГ. У всех 3 пациентов с НАА была достигнута
частичная ремиссия (100%). У 1 больного с ТАА
получена полная ремиссия (нестойкая), у 2 —
частичная ремиссия и у 1 — клиническое улучшение.
Исследования показали, что проведение повторных
курсов АЛГ у больных НАА и ТАА позволяет
достигать вполне удовлетворительных
результатов при отсутствии клинического ответа
на 1-й курс лечения.
В общей группе
больных AA (119 чел.) 5-летняя выживаемость составила
65% (рисунок). Среди больных НАА — 79%, у больных ТАА
— 51%.
Циклоспорин
А
Наш опыт применения
ЦсА (Сандиммун, Novartis) основан на результатах
лечения 16 больных АА (9 мужчин и 7 женщин в
возрасте от 6 до 60 лет), проводившегося на базе
гематологической клиники РосНИИГиТ и отделения
трансплантации костного мозга СПбГМУ им. акад. И.П.Павлова
в 1991–1999 гг.
Большинство
пациентов страдали ТАА — 14 чел. (87,5%). ЦсА
первоначально применяли в дозе 10 мг/кг веса
больного. Однако затем доза была снижена до 6 мг/кг
из-за развившихся выраженных токсических
осложнений — нарушений функции печени и почек с
повышением уровня билирубина и трансаминаз,
креатинина; диспептических проявлений,
гингивита, повышения артериального давления с
развитием носовых, десневых и других
кровотечений. Длительность терапии ЦсА
составила от 42 до 552 дней. Если при приеме
препарата в дозе 6 мг/кг отсутствовали какие-либо
осложнения в течение 2 нед, больного переводили
на дозу 3 мг/кг и наблюдали амбулаторно с
еженедельным контролем биохимических
показателей (билирубин, трансаминазы, креатинин
крови и др.) с клиническим анализом
периферической крови 1 раз в 2 нед.
Эффективность
препарата оценивалась нами в первые 11–12 нед,
если не было выраженных токсических осложнений.
У большинства больных результаты отмечались уже
через 1,5–2 мес от начала приема ЦсА. При этом
наблюдалась стабилизация состояния пациентов,
снижение геморрагического синдрома, рост
показателей периферической крови, в первую
очередь, уровня гемоглобина и числа эритроцитов.
Далее (3–6 мес) имели место нормализация числа
лейкоцитов и относительного содержания
нейтрофилов, снижение лимфоцитов. В результате
проводимого лечения у 13 больных получен
клинический ответ, из них у 3 достигнута полная
клинико-гематологическая ремиссия (18,8%), у 3 —
частичная ремиссия (18,8%), у 7— клиническое
улучшение. У 3 больных эффект на лечение ЦсА
отсутствовал, хотя отмечались некоторая
стабилизация состояния и снижение тяжести
геморрагических проявлений. Продолжительность
терапии ЦсА у больных, до-стигших полной или
частичной ремиссии составляла не менее 6 мес. При
этом попытки полностью прекратить терапию у
некоторых пациентов сопровождались ухудшением
показателей периферической крови и, в первую
очередь, падением уровня гемоглобина и числа
тромбоцитов. Одновременно нами было установлено,
что в большинстве случаев восстановление
кроветворения в костном мозге, по данным
трепанобиопсии, отмечалось лишь к концу 12-го
месяца от начала терапии.
* * *
Исследования
показали, что ТКМ остается основным методом
лечения у больных моложе 40 лет, имеющих HLA-идентичного
донора костного мозга. Усиление
иммуносупрессивного эффекта циклофосфана
включением АЛГ в режим кондиционирования
позволяет существенно улучшить результаты
лечения даже у больных, имевших в анамнезе до ТКМ
множественные гемотрансфузии.
Лечение больных,
старше 40 лет и(или) не имеющих HLA-совместимого
донора костного мозга, может успешно
осуществляться с помощью АЛГ и ЦсА, причем
последний имеет клиническое значение даже в дозе
3 мг/кг и менее и позволяет достигать полной и
частичной клинико-гематологической ремиссии.
Литература
- Gluckman E, Horowitz MM, Champlin RE
et al. Bone marrow transplantation for severe aplastic anemia: influence of conditioning
and graft-versus-disease prophylaxis regimen on outcome. Blood 1992; (79): 269–75.
- Storb R, Etzioni R, Anasetti C et
al. Cyclophosphamide combined with antithymocyte globulin in preparation for allogeneic
marrow transplants in patients with aplastic anemia. Blood 1994; (84): 941–9.
- Bacigalupo A, Hows J, Gluckman E
et al. Bone marrow transplantation versus immunosuppression for the treatment of severe
aplastic anemia: a report of the EBMT SAA Working Party. Br J Haematol 1988; (70): 177–82.
- Horstmann M, Stockschlader M, Kruger
W et al. Cyclophosphamide/antithymocyte globulin conditioning of patients with severe
aplastic anemia for marrow transplantation from HLA-matched siblings: preliminary results.
Ann Hematol 1995; (71): 77–81.
- Frickhoven N, Kaltwasser JP,
Schrezenmeier H et. al. for German Aplastic Anemia Study Group. Treatment of aplastic
anemia with antilymphocyte globulin and methylprednisolone with or without cyclosporine. N
Engl J Med 1991; (324): 1297–303.
- Schrezenmeier H, Hinterberger W, Hows
J et al. Second immunosuppressive treatment for patients with aplastic anemia not
responding to the first course of immunosuppression: a report for the Working Party on
Severe Aplastic Anemia of the EBMT. Bone Marrow Transplantation 1995; 15 (Suppl 2); A65.
|





