ОСЛОЖНЕНИЯ САХАРНОГО
ДИАБЕТА
(КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ,
ПРОФИЛАКТИКА)
ЭНДОКРИНОЛОГИЧЕСКИЙ НАУЧНЫЙ
ЦЕНТР
РОССИЙСКОЙ АКАДЕМИИ МЕДИЦИНСКИХ НАУК
Составители руководства:
к.м.н. Анциферов М.Б., к.м.н. Галстян Г.Р., к.м.н.
Миленькая Т.М., к.м.н. Смирнова Н.Б., к.м.н. Токмакова
А.Ю., к.м.н. Шестакова М.В., к.м.н. Лебедев Н.Б.
Под редакцией
АКАДЕМИКА РАМН ДЕДОВА И.И.
Москва 1995 год
ПРЕДИСЛОВИЕ
Сахарный диабет без
преувеличения занимает одну из драматических
страниц мировой медицины. Самая ранняя из всех
заболеваний инвалидизация, высокая смертность (третье
место после сердечно-сосудистой патологии и
злокачественных новообразований) определили
сахарный диабет в качестве первых приоритетов
национальных систем здравоохранения всех (без
исключения стран мира, закрепленных Сент-Винсентской
декларацией.
Количество больных диабетом в
мире превысило 100 млн.человек; в России - 8 млн.человек
и примерно столько же на стадии предиабета.
Ежегодно число больных увеличивается на 5-7%, а
каждые 12-15 лет -удваивается.
Такие поздние осложнения
диабета, как ретинопатия, нефропатия, синдром
диабетической стопы, включая прежде всего
гангрену, ишемическая болезнь сердца,
полинейропатия являются главной причиной
инвалидизации и смертности больных диабетом. В
настоящее время научно обоснованы эффективные
методы ранней диагностики, лечения и
профилактики осложнений диабета. Ключевым
фактором в профилактике поздних осложнений
является оптимальная компенсация
метаболических нарушении и прежде всего
нормализация гликемии.
Сент-Винсентская декларация
(1989 г.) определила глобальную концепцию лечения и
профилактики поздних осложнений, предложив
национальным системам здравоохранения создать
специализированную высококачественную помощь
больным диабетом по осложнениям.
В Эндокринологическом научном
центре РАМН в последние 5 лет сформированы
коллективы ученых и врачей, прошедших
специализацию в ведущих клиниках Европы; создана
современная материально-техническая база для
диагностики и лечения поздних осложнений
диабета; проводятся учебные циклы и научные
семинары по актуальным вопросам диабетологии. И
в настоящем Руководстве кратко обобщены
алгоритмы диагностики, лечения и профилактики
поздних осложнении сахарного диабета,
основанные на ключевых клинических критериях и
гормонально-метаболических маркерах, отвечающих
международным стандартам.
Президент Российской
Ассоциации Эндокринологов,
Директор Сотрудничающего Центра ВОЗ по
сахарному диабету
Академик Российской Академии Медицинских наук
И. И. Дедов
ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ
Диабетическая нефропатия в
настоящее время является ведущей причиной
высокой инвалидизации и смертности больных
сахарным диабетом. Частота развития
диабетической нефропатии колеблется от 40 до 50% у
больных инсулинзависимым диабетом (ИЗСД) и от 15
до 30% у больных инсулиннезависимым диабетом (ИНСД).
Опасность этого осложнения состоит в том, что
развиваясь достаточно медленно и постепенно,
диабетическое поражение почек долгое время
остается незамеченным, поскольку клинически не
вызывает у больного ощущения дискомфорта. И
только уже на выраженной (нередко терминальной)
стадии патологии почек у больного появляются
жалобы, связанные с интоксикацией организма
азотистыми шлаками, однако на этой стадии
радикально помочь больному не всегда
представляется возможным. Поэтому основная
задача врача-терапевта, эндокринолога или
нефролога заключается в своевременной
диагностике диабетической нефропатии и
проведении адекватной патогенетической терапии
этого осложнения.
Стадии развития
диабетической нефропатии
Современная классификация стадий развития
диабетической нефропатии (по Mogensen С. Е.)
представлена в таблице 1.
Таблица 1.
Стадии развития диабетической нефропатии
| Стадия ДН |
Клинико-лабораторная
характеристика |
Сроки
развития |
1.
Гиперфункция почек
|
- увеличение СКФ
(> 140 мл/мин);
- увеличение ПК;
- гипертрофия почек;
- нормоальбуминурия
(< 30 мг/сут). |
Развивается в дебюте
сахарного диабета
|
2.
Стадия начальных структурных изменений ткани
почек
|
- утолщение базальных мембран
- капилляров клубочков;
- расширение мезангиума;
- сохраняется высокая СКФ;
- нормоальбуминурия. |
2-5 лет от начала диабета
|
3.
Начинающаяся нефропатия
|
- микроальбуминурия
(от 30 до 300 мг/сут);
- СКФ высокая или нормальная; -нестойкое
повышение АД; |
5-15 лет от начала диабета
|
4.
Выраженная нефропатия
|
- протеинурия
(более 500 мг/сут);
- СКФ нормальная или умеренно сниженная;
- артериальная гипертензия. |
10-25 лет от начала диабета
|
5.
Уремия
|
- снижение СКФ
< 10 мл/мин;
- артериальная гипертензия;
- симптомы интоксикации. |
более 20 лет от начала диабета
или 5-7 лет от появления протеинурии
|
Примечания:
СКФ - скорость клубочковой фильтрации
ПК - почечный кровоток
Первые три стадии
диабетической нефропатии не диагностируются при
стандартном обследовании больного, однако
только эти стадии являются обратимыми при
своевременно начатом лечении. Появление
протеинурии - первого рутинного лабораторного
признака диабетической нефропатии -
свидетельствует уже о глубоком и необратимом
поражении почек. Поэтому для предупреждения
развития и быстрого прогрессирования
диабетического поражения почек необходимо
АКТИВНО выявлять ранние стадии диабетической
нефропатии.
Диагностика
диабетической нефропатии
Диагностика диабетической
нефропатии на ранних стадиях
Наиболее ранним критерием развития
диабетической нефропатии (до появления
протеинурии) является МИКРОАЛЬБУМИНУРИЯ. Под
этим термином подразумевают экскрецию альбумина
с мочой, превышающую допустимые нормальные
значения, но не достигающую степени протеинурии.
В норме экскретируется не более 30 мг альбумина в
сутки, что эквивалентно концентрации альбумина
менее 20 мг/л в разовом анализе мочи. При появлении
протеинурии экскреция альбумина с мочой
превышает 300 мг/сутки. Поэтому диапазон
микроальбуминурии составляет от 30 до 300 мг/сутки
или от 20 до 200 мкг/мин (табл.2). Появление у больного
сахарным диабетом постоянной микроальбуминурии
свидетельствует о скором развитии (в течение
ближайших 5-7 лет) выраженной стадии
диабетической нефропатии.
Таблица 2. Классификация
альбуминурии
| |
Экскреция
альбумина с мочой |
Концентрация
альбумина |
при кратковременном
сборе мочи |
за сутки |
НОРМОАЛЬБУ
МИНУРИЯ |
<20 мкг/мин |
<30 мг |
<20 мг/л |
МИКРОАЛЬБУ
МИНУРИЯ |
20-200 мкг/мин |
30-300 мг |
20-200 мг/л |
МАКРОАЛЬБУ
МИНУРИЯ |
>200 мкг/мин |
>300 мг |
>200 мг/л |
Существуют различные методы экспресс-диагностики
микроальбуминурии: тест-полоски для мочи
"Micral-Test" ("Boehringer Mannheim", Германия),
абсорбирующие таблетки "Micro-Bumintest"
("Bayer", Германия) и другие. Используя эти
методы, можно быстро в течение 5 мин с достаточной
степенью точности определить наличие в моче
микроконцентраций альбумина.
Если при разовом анализе мочи
неоднократно выявляется концентрация альбумина
более 20 мг/л, то требуется исследование суточной
мочи. При выявлении в моче, собранной за сутки,
концентрации альбумина более 30 мг, и это значение
подтверждается в последующих анализах мочи,
повторенных через 6 и 12 недель, следует
выставлять диагноз НАЧИНАЮЩЕЙСЯ ДИАБЕТИЧЕСКОЙ
НЕФРОПАТИИ и начинать превентивное лечение.
Однако следует иметь в виду, что экскреция
альбумина с мочой может повышаться после
интенсивных физических нагрузок, при инфекции
мочевыводящих путей и застойной сердечной
недостаточности.
Другим ранним маркером ДН
является нарушенная внутрипочечная
гемодинамика (ГИПЕРФИЛЬТРАЦИЯ, ГИПЕРПЕРФУЗИЯ
ПОЧЕК, ВНУТРИКЛУБОЧКОВАЯ ГИПЕРТЕНЗИЯ). Гиперфильтрация
характеризуется повышением СКФ более 140 мл/мин х
1.73 м. Для определения СКФ используют пробу
Реберга-Тареева, основанную на исследовании
клиренса эндогенного креатинина за сутки.
Гиперперфузия почек характеризуется повышением
почечного кровотока. Внутриклубочковая
гипертензия характеризуется повышенным
давлением крови в капиллярах почечных клубочков
и, в настоящее время считается основной причиной
развития диабетической нефропатии. Измерить
внутриклубочковую гипертензию в клинических
условиях пока не представляется возможным.
Диагностика диабетической
нефропатии на поздних стадиях
Лабораторными критериями, характеризующими
развитие выраженной стадии ДН, являются
ПРОТЕИНУРИЯ, (как правило, при неизмененном
осадке мочи), СНИЖЕНИЕ СКОРОСТИ КЛУБОЧКОВОИ
ФИЛЬТРАЦИИ (СКФ), нарастание АЗОТЕМИИ (мочевины и
креатинина сыворотки крови), нарастание
АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ. У 30% больных
развивается НЕФРОТИЧЕСКИИ СИНДРОМ, признаками
которого являются массивная протеинурия (более
3,5 г/сутки),. гипоальбуминемия,
гиперхолестеринемия, отечность вплоть до
анасарки. С момента появления постоянной
протеинурии темп снижения СКФ составляет в
среднем 2 мл/мин/мес, что приводит к развитию
терминальной почечной недостаточности уже через
5-7 лет после выявления протеинурии.
Скрининг
диабетической нефропатии на различных стадиях
ее развития
При отсутствии протеинурии необходимо
исследовать наличие МИКРОАЛЬБУМИНУРИИ:
у больных ИЗСД
- не реже 1 раза в год спустя 5 лет
от начала заболевания (при дебюте диабета после
пубертата);
- не реже 1 раза в год с момента
установления диагноза диабета в возрасте до 12
лет;
у больных ИНСД
- не реже 1 раза в год с момента
установления диагноза диабета.
При наличии протеинурии
необходимо исследовать:
1. Скорость нарастания
протеинурии (в суточной моче).
2. Скорость снижения СКФ (по клиренсу креатинина)
3. Скорость нарастания артериальной гипертензии
Все перечисленные
исследования проводить не реже 1 раза в 4 - 6
месяцев.
Профилактика и
лечение диабетической нефропатии в зависимости
от ее стадии
При нормальной экскреции
альбумина с мочой
1. Тщательная коррекция углеводного обмена:
- стремиться к поддержанию
уровня гликозилированного гемоглобина (НВА1) не
более 8,7% (при норме до 8% методом хроматографии на
микроколонках, "Boehringer Mannheim", Германия).
При наличии микроальбуминурии
1. Тщательная коррекция углеводного обмена:
- режим интенсифицированной
инсулинотерапии при ИЗСД и перевод на
инсулинотерапию больных ИНСД в случае плохой
компенсации при приеме пероральных
сахароснижающих средств;
2. Коррекция артериального
давления:
- у больных в возрасте до 60 лет
начинать гипотензивную терапию при повышении АД
более 140/90 мм рт.ст., а у больных в возрасте после 60
лет - при повышении АД более 160/90 мм рт.ст.
- среди антигипертензивных
средств предпочтительнее назначать терапию
ингибиторами ангиотензин- превращающего
фермента - капотен (каптоприл), ренитек (эналаприл),
тритаце (рамиприл), поскольку эти препараты
обладают не только высокой гипотензивной
активностью, но и специфическим
нефропротективным эффектом;
- избегать назначения
неселективных бета-блокаторов (типа обзидана,
анаприлина) и тиазидовых диуретиков (типа
гипотиазида) особенно у больных ИНСД, получающих
таблетированные сахароснижающие средства,
поскольку эти препараты ухудшают углеводный и
липидныи обмен.
3. Коррекция внутрипочечной
гемодинамики:
- ингибиторы ангиотензин-превращающего
фермента (даже при нормальном уровне АД)
При наличии протеинурии
1. Коррекция углеводного обмена.
2. Коррекция артериального давления с
предпочтительным назначением ингибиторов
ангиотензин-превращающего фермента (см.выше)
3. Малобелковая диета:
- рекомендуется ограничивать
потребление животного белка в диете до 0,6-0,7 г/кг
массы тела (в среднем до 40 г белка/сутки),
желательно замещение животного белка
растительным. Допустимо расширение углеводного
рациона для покрытия энергозатрат. Диета
больного должна составляться при участии
диетолога.
4. Коррекция липидного обмена:
- нарастание протеинурии, как
правило, сопровождается развитием
гиперлипидемии с преобладанием атерогенных
фракций липидов, в связи с чем рекомендуется
соблюдать гиполипидемическую диету. При
повышении общего холестерина более 6,5 ммоль/л (норма
до 5,2) и триглицеридов сыворотки более 2,2 ммоль/л (норма
до 1,7) рекомендуется присоединение лекарственных
средств, нормализующих липидный спектр крови (никотиновая
кислота, фибраты, ингибиторы
гидроксиметилглютарил коэнзим А-редуктазы -
мевакор, правахол и др.).
На стадии хронической почечной
недостаточности (ХПН):
- у больных ИЗСД при
прогрессировании ХПН суточная потребность в
инсулине резко снижается (вследствие угнетения
активности почечной инсулиназы,
метаболизирующей инсулин). В связи с этим
возрастает частота гипогликемических состояний,
что требует снижения дозы инсулина;
- у больных ИНСД, получающих
терапию пероральными сахароснижающими
средствами, при развитии ХПН рекомендуется
перевод на инсулинотерапию, поскольку
большинство этих препаратов метаболизируется и
выводится почками. Исключение составляет
препарат ГЛЮРЕНОРМ (гликвидон, "Boehringer Ingelheim",
Австрия), экскретируемыи через билиарный тракт,
что позволяет его использовать у больных с
начальной стадией ХПН (креатинин сыворотки крови
не более 200 мкмоль/л);
- при повышении креатинина
сыворотки крови более 200 мкмоль/л (или 2,2 мг%)
возникает необходимость в курации больных
совместно с нефрологом для решения вопроса о
тактике консервативного лечения таких больных;
- при повышении креатинина
сыворотки крови более 500 мкмоль/л (или 5,5 мг%)
решается вопрос о подготовке пациентов к
экстракорпоральным (ГЕМОДИАЛИЗ, ПЕРИТОНЕАЛЬНЫИ
ДИАЛИЗ) или хирургическим (ТРАНСПЛАНТАЦИЯ ПОЧКИ)
методам лечения.
Показания к
экстракорпоральным и хирургическим методам
лечения диабетической нефропатии
Трансплантация почки
- при повышении креатинина
сыворотки крови до 8-9 мг% (600-700 мкмоль/л) и снижении
скорости клубочковои фильтрации < 25 мл/мин
Гемодиализ или перитонеальный
диализ
- при повышении креатинина
сыворотки крови до 12- 16 мг% (1000-1200 мкмоль/л) и
снижении скорости фильтрации < 10 мл/мин
ДИАБЕТИЧЕСКАЯ
РЕТИНОПАТИЯ
Диабетическая ретинопатия
является одной из основных причин слепоты среди
населения развитых стран мира. Слепота у больных
сахарным диабетом наступает в 25 раз чаще, чем в
общей популяции (ВОЗ, 1987 г.). Инвалидность по
зрению отмечается более чем у 10% больных сахарным
диабетом. Патологические изменения на глазном
дне в большинстве случаев возникают через 5-10 лет
от начала заболевания. Наиболее тяжелой формой
поражения является пролиферативная
диабетическая ретинопатия, приводящая, как
правило, к инвалидизации. По данным ряда авторов
пролиферативная ретинопатия развивается более
чем у 40% больных. Ретинальные сосудистые
осложнения проявляются как у больных с
инсулинзависимым, так и инсулиннезависимым
сахарным диабетом.
Методы
исследования органа зрения
- наружный осмотр глазного
яблока;
- определение остроты зрения;
- исследование полей зрения (на
периметре Гольдмана);
- исследование роговицы,
радужной оболочки, угла перед ней камеры глаза (с
помощью щелевой лампы);
- тонометрия (тонометром
Маклакова).
Если позволяет уровень
внутриглазного давления, то дальнейшее
исследование проводится при расширенном зрачке.
- биомикроскопия хрусталика и
стекловидного тела с помощью щелевой лампы;
- ультразвуковое исследование
при наличии значительных помутнении в
стекловидном теле и хрусталике, затрудняющих
офтальмоскопию;
- электрофизиологические методы
исследования для определения функционального
состояния зрительного нерва и сетчатки.
- исследование глазного дна.
К методам исследования
глазного дна относятся:
- метод офтальмоскопии при
расширенных зрачках. С помощью офтальмоскопа
исследуется состояние сетчатки последовательно
от центра до периферии по всем меридианам,
тщательно осматривается диск зрительного нерва,
макулярная область, разветвления крупных
сосудов. Обязательным условием является
проведение офтальмоскопии квалифицированным
специалистом, которым может быть не только
офтальмолог, но и специально подготовленный
эндокринолог.
- фотографирование глазного дна
с помощью стандартной или немидриатической
камеры (Canon, Япония). Этот метод дает возможность
получить документальную информацию о состоянии
глазного дна. Данный вид обследования может
проводиться не только офтальмологами, но и
другим медицинским персоналом с последующей
расшифровкой снимков специалистом.
- флюоресцентная ангиография (ФАГ)
позволяет объективно регистрировать циркуляцию
флюоресцина в ретинальных и хореоретинальных
сосудистых системах, что важно для диагностики
функциональных и органических изменений в
структурах глазного дна. ФАГ помогает выявить
"протекающие" капилляры.
В процессе исследования
необходимо выявить изменения сетчатки,
указывающие на наличие ретинопатии с риском
прогрессирующего поражения и слепоты,
свидетельствующие о вероятности
неблагоприятного исхода на протяжении
следующего года. Основной задачей является
выявление больных, которым лечение показано для
предупреждения потери зрения.
Классификация
диабетической ретинопатии
В настоящее время в большинстве стран
используется классификация диабетической
ретинопатии, предложенная E. Kohner и M. Porta. Согласно
данной классификации выделяют следующие
основные формы (стадии) диабетической
ретинопатии:
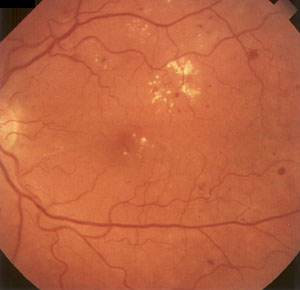
1. Непролиферативная
ретинопатия (ДР 1)
характеризуется наличием в сетчатке
патологических изменении в виде микроаневризм,
кровоизлияний, отека сетчатки, экссудативных
очагов (рис.1). Кровоизлияния имеют вид небольших
точек или пятен округлой формы, темного цвета,
локализуются в центральной зоне глазного дна или
по ходу крупных вен в глубоких слоях сетчатки.
Также возникают кровоизлияния штрихообразного
вида. Твердые и мягкие экссудаты локализуются, в
основном, в центральной части глазного дна и
имеют желтый или белый цвет, четкие или
расплывчатые границы. Важным элементом
непролиферативной диабетической ретинопатии
является отек сетчатки, локализующийся в
центральной (макулярной) области или по ходу
крупных сосудов.
Рис. 1
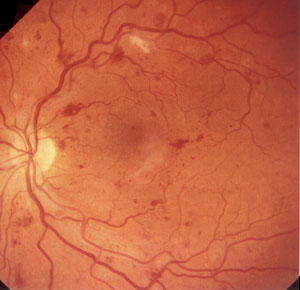
2. Препролиферативная ретинопатия (ДР II)
характеризуется наличием венозных аномалий (четкообразность,
извитость, петли, удвоение и/или выраженные
колебания калибра сосудов), большим количеством
твердых и "ватных" экссудатов,
интраретинальными микрососудистыми аномалиями (ИРМА),
множеством крупных ретинальных геморрагий (рис.2).
Рис. 2
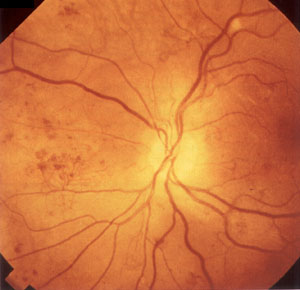
3. Пролиферативная ретинопатия (ДР III)
характеризуется неоваскуляризацией диска
зрительного нерва и/или других отделов сетчатки,
кровоизлияниями в стекловидное тело,
образованием фиброзной ткани в области
преретинальных кровоизлиянии (рис.З).
Новообразованные сосуды весьма тонкие и хрупкие.
В следствие этого часто возникают новые и
повторные кровоизлияния. Образованные
витриоретинальные тракции приводят к отслойке
сетчатки. Новообразованные сосуды радужной
оболочки (рубеоз) часто являются причиной
развития вторичной (рубеозной) глаукомы.
Рис. 3
Основные принципы лечения диабетической
ретинопатии
Лечение диабетической ретинопатии
рассматривается как неотъемлемая часть лечения
больного в целом и основано на следующих
принципах:
- выявление поражения сетчатки (скрининг)
и последующее динамическое наблюдение за ее
состоянием (мониторинг);
- оптимальная компенсация
углеводного и липидного обмена, контроль
артериального давления, нормализация функции
почек и т.д.;
- лечение поражения сетчатки.
Скрининг
диабетической ретинопатии
В задачу скрининга входит выявление больных с
повышенной степенью риска в отношении развития
диабетической ретинопатии (например, при
сочетании ретинопатии с беременностью,
артериальной гипертонией, хронической почечной
недостаточностью), которые нуждаются в
тщательном наблюдении.
Выделяют следующие этапы
скрининга:
- сбор и анализ данных анамнеза,
клинического и лабораторного обследования;
- верификация начальных сроков
проявления нарушений зрительных функций;
- наличие данных о глаукоме;
- определение остроты зрения с
коррекцией;
- обязательное расширение зрачка;
- исследование хрусталика;
- исследование глазного дна.
Оптимизация
метаболического контроля
На всех стадиях диабетической ретинопатии
должно проводиться лечение основного
заболевания, направленное на коррекцию
метаболических нарушений. Согласно данным
многих клинических и экспериментальных работ
существует четкая корреляция между степенью
компенсации гликемии и развитием диабетической
ретинопатии. Завершившееся в 1993 году в США
исследование влияния степени контроля
метаболических нарушений у больных ИЗСД на
развитие микрососудистых осложнений показало,
что чем лучше проводился контроль гликемии, тем
меньше были риск и частота развития
диабетической ретинопатии. Поэтому в настоящее
время основным способом профилактики
диабетической ретинопатии является поддержание
длительной и максимально стабильной компенсации
сахарного диабета. Строгий контроль уровня
гликемии и адекватная терапия сахарного диабета
должны быть организованы как можно раньше от
начала заболевания.
Использование в лечебных или
профилактических целях для оказания влияния на
диабетические изменения глазного дна таких
ангиопротекторов как трентал, диваскан, доксиум,
дицинон, ангинин и др. признано малоэффективным,
особенно на фоне неудовлетворительной
компенсации углеводного обмена. В настоящее
время в большинстве развитых стран мира ни для
лечения, ни для профилактики диабетической
ретинопатии данные препараты не применяются.
Основные финансовые средства целесообразно
направлять на обучение больных, на средства
контроля гликемии, глюкозурии,
микроальбуминурии, на лучшие по качеству
лекарства (человеческий инсулин и средства его
введения).
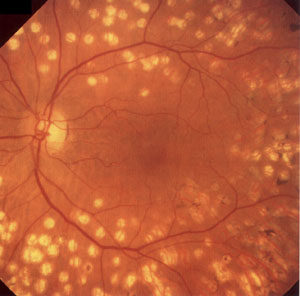
Лазерная фотокоагуляция
Более чем двадцатипятилетний опыт использования
лазерной фотокоагуляции показывает, что в
настоящее время этот метод является наиболее
эффективным в лечении диабетической ретинопатии
и предупреждении слепоты (рис.4). Лазерная
фотокоагуляция направлена на прекращение
функционирования новообразованных сосудов,
представляющих основную угрозу развития
инвалидизирующих изменений в органе зрения:
гемофтальма, тракционной отслойки сетчатки,
рубеоза радужки и вторичной глаукомы. В
пораженных отделах сетчатой оболочки происходит
выработка особого фактора, стимулирующего
пролиферацию сосудов. Использование лазерной
фотокоагуляции с целью воздействия на зоны
ишемии сетчатой оболочки ведет к регрессу
новообразованных сосудов. Своевременно и
квалифицированно проведенное лечение позволяет
сохранить зрение на поздних стадиях
диабетической ретинопатии у 60% больных в течение
10-12 лет. Этот показатель может быть и выше, если
лечение начать на более ранних стадиях.
Рис. 4
Используют три основных метода проведения
лазерной фотокоагуляции:
1. Фокальная лазерная фотокоагуляция, которая
заключается в нанесении коагулятов в местах
просвечивания флюоресцина при проведении
ангиографии, на участках локализации
микроаневризм, мелких кровоизлияний, экссудатов.
2. Барьерная лазерная фотокоагуляция, которая
заключается в нанесении мелких коагулятов
парамакулярно в несколько рядов. Этот метод
применяется при непролиферативной
диабетической ретинопатии в сочетании с отеком
макулярной области.
3. Панретинальная лазерная фотокоагуляция,
которая заключается в нанесении коагулятов
практически по всей площади сетчатки, исключая
макулярную область. Данный метод применяется, в
основном, при препролиферативной диабетической
ретинопатии, характеризующейся наличием
обширных участков ишемии сетчатки с тенденцией к
дальнейшему прогрессированию.
Перед проведением лазерной
фотокоагуляции больной должен быть информирован
о том, что лечение направлено на предотвращение
дальнейшего снижения остроты зрения, а не на
восстановление нормальной остроты зрения.
Больного следует предупредить о возможных
осложнениях лечения. Наиболее частыми
осложнениями после проведения лазерной
фотокоагуляции (до 10-17%) являются кровоизлияния в
сетчатку и стекловидное тело. Очень интенсивная
лазерная фотокоагуляция может привести к
частичной атрофии зрительного нерва,
макулопатии; иногда возникает кератопатия или
иридоциклит. Поэтому необходимо подчеркнуть, что
проводить лазерную фотокоагуляцию должен
опытный, квалифицированный специалист.
Показания к
лазерной фотокоагуляции
Непролиферативная диабетическая ретинопатия в
большинстве случаев протекает благоприятно и не
требует проведения срочной лазерной коагуляции.
Необходимость в коагуляции возникает только при
прогрессировании патологического процесса.
Стабилизировать
патологический процесс при препролиферативной и
пролиферативной диабетической ретинопатии
возможно только путем раннего проведения
лазерной фотокоагуляции. Применение лазерной
коагуляции наиболее целесообразно в самом
начале возникновения сосудистой пролиферации,
так как при наличии шварт в стекловидном теле, а
также на поздних стадиях процесса
фотокоагуляция значительно затруднена и может
привести к таким осложнениям, как гемофтальм и
тракционная отслойка сетчатки.
Сроки проведения
лазерной фотокоагуляции
1. Отек макулы или макулопатия:
а) при острой форме - срочно;
б) при хронической форме - в течение
нескольких недель.
2. Пролиферативная ретинопатия:
а) при центральной форме (новообразованные
сосуды на диске зрительного нерва) - срочно;
б) при периферической форме (новообразованные
сосуды в других местах сетчатки) - не откладывая,
в течение 1-2 недель.
3. Препролиферативная ретинопатия:
а) при наличии дополнительных факторов риска
- не откладывая, в течение нескольких недель;
б) при отсутствии факторов риска - в течение 2-3
месяцев.
Витрэктомия
Одним из самых частых осложнений
пролиферативной диабетической ретинопатии
является рецидивирующее кровоизлияние в
стекловидное тело. Стекловидное тело при этом
претерпевает грубые деструктивные и
пролиферативные изменения.
Одним из наиболее радикальных
и эффективных методов лечения гемофтальма при
диабетической ретинопатии является закрытая
витрэктомия. Этот метод позволяет удалить
патологические образования из стекловидного
тела, восстановить его прозрачность и улучшить
зрительные функции глаза, а также предотвратить
развитие осложнений, связанных с последствиями
кровоизлияний в стекловидное тело.
Организация контроля (мониторинга)
за состоянием глазного дна
Очень важно помнить, что даже выраженные
диабетические изменения со стороны глазного дна
асимптоматичны: острота зрения остается хорошей.
Больной не подозревает о них, если регулярно не
проходит обследования у офтальмолога, или до тех
пор, пока у него не происходит необратимого
ухудшения зрения. Поэтому так важен регулярный,
плановый контроль за состоянием глаз у больных
сахарным диабетом.
Частота
проведения осмотров:
- первое обследование: пациент
должен быть осмотрен окулистом не более чем
через 5 лет с момента установления диагноза
диабета. В отечественных условиях, учитывая
недостаточный уровень компенсации заболевания,
целесообразно первый осмотр проводить не позже
чем через 1,5-2 года с момента установления
диагноза диабета;
- при отсутствии диабетической
ретинопатии: не реже одного раза в 1-2 года;
- при наличии признаков
диабетической ретинопатии: осмотр должен
проводиться не менее 1 раза в год, а при
необходимости и чаще, например при наличии
признаков быстрого прогрессирования
диабетической ретинопатии, при интеркуррентных
заболеваниях;
- при сочетании диабетической
ретинопатии с беременностью, артериальной
гипертонией, хронической почечной
недостаточностью, формируются группы риска,
нуждающиеся в индивидуальном контроле за
развитием этого осложнения.
Офтальмологическое
обследование женщин больных сахарным диабетом,
пожелавших иметь ребенка, необходимо проводить
до начала беременности (до зачатия, в период
планирования беременности), после ее
подтверждения, а затем каждые 3 месяца, а при
необходимости и чаще, а также в случае
преждевременного прерывания беременности.
Вероятность развития тяжелой
ретинопатии в препубертатном возрасте невелика,
поэтому офтальмологическое обследование детей в
возрасте до 10 лет как правило не проводится. Его
следует приурочить к началу полового созревания.
В это время и в дальнейшем следует проводить
обследование по меньшей мере с 2-х летними
интервалами, при обнаружении диабетической
ретинопатии - не реже 1 раза в год, а в случае
интеркуррентного заболевания или ухудшения
функции почек - еще чаще.
При неожиданном снижении
остроты зрения или появлении у больных диабетом
каких-либо других жалоб на зрение, обследование
должно быть проведено немедленно, вне
зависимости от сроков очередного визита к
офтальмологу.
СИНДРОМ
ДИАБЕТИЧЕСКОЙ СТОПЫ
Синдром диабетической стопы является сложным
комплексом анатомо-функциональных изменений,
который встречается в различной форме у 30-80%
больных сахарным диабетом. Ампутации нижних
конечностей у данной группы пациентов
производятся в 15 раз чаще, чем у остального
населения. По данным ряда авторов от 50 до 70% от
общего количества всех выполненных ампутации
нижних конечностей приходится на долю больных
сахарным диабетом. В 1993 году в Российской
Федерации было произведено около 12000 ампутаций
нижних конечностей на различных уровнях у
больных сахарным диабетом.
В патогенезе развития синдрома
диабетической стопы ведущее место занимают три
основных фактора:
- нейропатия;
- поражение артерий нижних
конечностей;
- инфекция.
Последний фактор, как правило,
является сопутствующим по отношению к двум
первым. Исходя из преобладания нейропатических
изменений или нарушений периферического
кровотока различают две основные клинические
формы синдрома диабетической стопы:
- нейропатическая (рис.5);
- ишемическая (рис.6).
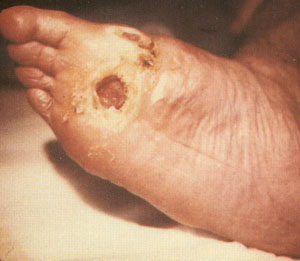
Рис.5 Нейропатическая форма диабетической
стопы с трофической инфицированной язвой.
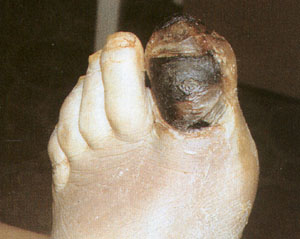
Рис.6 Гангрена нижней конечности вследствие
поражения периферических сосудов у больного
сахарным диабетом (ишемическая форма).
Наряду с двумя основными
формами поражения нижних конечностей при
сахарном диабете также выделяют третью:
- смешанную (нейро-ишемическую).
При нейропатической форме
имеет место поражение соматической и
вегетативной нервной системы при интактности
артериальных сегментов нижних конечностей.
Нейропатия может приводить к следующим трем
видам поражений стоп:
- нейропатическои язве;
- остеоартропатии (с
последующим развитием сустава Шарко);
- нейропатическим отекам.
Ишемическая форма развивается
как следствие атеросклеротического поражения
артерий нижних конечностей, что приводит к
нарушению магистрального кровотока. При этом
могут иметь место также и нейропатические
изменения. Однако снижение или полное отсутствие
пульсации на артериях стоп и голеней, холодные
при пальпации конечности, болевая симптоматика,
а также характерная локализация язвенных
дефектов по типу акральных некрозов позволяют
дифференцировать нейропатические и смешанные (нейро-ишемические)
формы поражения стоп.
Нейропатическая форма
синдрома диабетической стопы
Нейропатический дефект возникает на участках
стопы, испытывающих наибольшее давление,
особенно часто на плантарной поверхности и в
межпальцевых промежутках. Длительно протекающая
сенсомоторная нейропатия приводит к деформации
стопы, что способствует перераспределению и
чрезмерному увеличению давления на ее отдельные
участки, например, в области проекции головок
метатарзальных костей. В этих местах отмечается
утолщение кожи, формирование гиперкератозов,
имеющих достаточно высокую плотность.
Постоянное давление на эти участки приводит к
воспалительному аутолизу подлежащих мягких
тканей, формированию язвенного дефекта. При этом
пациент может не замечать происходящих
изменении из-за сниженной болевой
чувствительности.
Очень часто формирование
язвенного поражения происходит по причине
неправильного подбора обуви. Как было сказано
выше, сенсомоторная нейропатия приводит к
характерной деформации стопы. С другой стороны,
очень часто имеет место наличие
нейропатического отека (подробнее см.дальше).
Таким образом, стопа больного меняет не только
форму, но и размеры. В тоже время обувь
подбирается больными исходя из знания своих
прежних размеров, причем учитываются один или
два измерения. Сниженная чувствительность не
позволяет пациенту своевременно обнаружить
неудобство новой обуви и, как следствие этого,
приводит к образованию потертостей, язв.
Ноги пациентов могут
подвергаться воздействию различных
повреждающих факторов. Из-за повышения порога
чувствительности больные могут не почувствовать
воздействие высокой температуры, например, ожог
тыльной поверхности стопы при приеме солнечных
ванн, или плантарной поверхности стопы при
хождении босиком по горячему песку. Из
химических факторов следует отметить
повреждающее действие кератолитических мазей,
имеющих в своем составе салициловую кислоту,
которая может привести к образованию язвы.
Язвенный дефект часто
инфицируется стафилококками, стрептококками,
колибактериями. Нередко имеет место
присоединение анаэробной микрофлоры. Патогенные
микроорганизмы продуцируют гиалуронидазу, что
ведет к распространению некротических изменений
с охватом подкожно-жировой клетчатки, мышечной
ткани, костно-связочного аппарата, в тяжелых
случаях происходит тромбоз мелких сосудов и, как
следствие, вовлечение в процесс новых обширных
участков мягких тканей. Инфицированное
поражение стопы, может сопровождаться
образованием газа в мягких тканях, что
обнаруживается как пальпаторно, так и
рентгенологически. Это состояние сопровождается,
как правило, гипертермией, лейкоцитозом. В таких
случаях необходимо срочное хирургическое
вмешательство с проведением некрэктомии,
назначение адекватной антибиотикотерапии,
тщательный контроль за гликемией.
Принципы консервативной
терапии нейропатической инфицированной формы
синдрома диабетической стопы.
Своевременно и адекватно проводимая
консервативная терапия неиропатической
инфицированной формы поражения стоп позволяет
избежать хирургического вмешательства в 95%
случаев. Лечение нейропатической инфицированной
стопы включает следующие основные компоненты:
1. Оптимизация
метаболического контроля
В большинстве случаев у пациентов, имеющих
язвенные поражения стоп, отмечается выраженная
гипергликемия. Для обеспечения условий
благоприятствующих заживлению важно достижение
состояния компенсации углеводного обмена. При
ИЗСД проводится интенсификация режима
инсулинотерапии. Потребность организма в
инсулине может возрасти значительно из-за
наличия инфекционно-воспалительного процесса и
высокой температуры, следовательно это требует
соответствующего повышения дозы вводимого
инсулина. Поэтому ориентиром оптимального
количества препарата является не показатель
соотношения дозы инсулина и массы тела пациента,
а показатели гликемии.
Очень часто синдром
диабетической стопы развивается у больных ИНСД
на фоне выраженной декомпенсации заболевания, не
поддающейся коррекции несмотря на диетотерапию
и лечение пероральными сахароснижающими
препаратами. Таких больных ИНСД, при наличии
незаживающих неиропатических язв или
выраженного болевого синдрома, рекомендуется
переводить на инсулинотерапию. В таких случаях
назначение инсулина позволяет нормализовать
гликемию и поддерживать хороший метаболический
контроль.
2. Антибиотикотерапия
Сухая, истонченная кожа нейропатической стопы с
нарушением целостности обладает сниженными
барьерными свойствами против проникновения
микроорганизмов, находящихся на ее поверхности.
При наличии инфекционного поражения мягких
тканей стопы необходимо назначение
антибиотикотерапии. Препаратами выбора могут
быть:
- цефалоспорины;
- линкомицин, клиндамицин;
- эритромицин;
- оксациллин, ампиокс.
Вид, доза препарата и
длительность лечения определяется исходя из
данных бактериологического исследования
микрофлоры раневого отделяемого, тяжести
процесса и скорости заживления язвы.
3. Разгрузка пораженного
участка
Полный покой и разгрузка стопы могут
привести к заживлению в течение нескольких
недель даже годами существующих язв. При этом
могут быть использованы как кресло-каталка,
костыли, так и специальная разгрузочная обувь.
4. Местная обработка раны
Местная обработка раны включает удаление
некротических тканей, обработку краев язвы и
обеспечение асептичности раневой поверхности и
близлежащих участков стопы.
5. Удаление участков
гиперкератоза
При наличии участков гиперкератоза необходимо
своевременное их удаление с помощью скальпеля с
укороченным лезвием. Эта процедура производится
специально обученым медицинским персоналом. В
некоторых случаях после удаления мозоли
обнаруживается язвенный дефект.
6. Правильный подбор и ношение
специальной обуви
Лечение больных с
нейропатическими язвами
Если имеет место нарушение целостности кожи без
вовлечения подлежащих мягких тканей, то больному
достаточно следовать рекомендуемому режиму
разгрузки конечности или пораженной области и
проводить местную обработку язвенной
поверхности антисептиками (раствор фурациллина,
диоксидина). При обнаружении признаков
инфицирования язвы, вовлечения в патологический
процесс подкожно-жировой клетчатки и мышецной
ткани необходимо назначение антибактериальной
терапии.
Диабетическая
остеоартропатия (сустав Шарко)
Костные изменения проявляются остеопорозом,
остеолизом, гиперостозом. Начальные изменения в
костях могут не проявляться при
ретгенологическом исследовании. В связи с этим
для ранней диагностики изменений костно-связочного
аппарата используется метод ультразвукового
сканирования кости. Деструктивные изменения
могут прогрессировать в течение нескольких
месяцев и привести к выраженной деформации стопы.
Развитие указанных
деструктивных изменении является причиной
высокой предрасположенности данной категории
пациентов к переломам костей стопы при сравнении
с лицами без нейропатии. Наличие у больного
нейропатии может маскировать спонтанные
переломы костей стопы; болезненность отмечают
лишь треть пациентов. Если после перелома прошло
несколько дней, то на рентгенограмме может быть
нормальная картина, в то время как при
сканировании отмечаются значительные изменения.
Пальпаторно отмечается гипертермия области
стопы; при сравнении с контрлатеральной
конечностью - стопа отечная. Очень часто данное
состояние ошибочно расценивают как тромбоз
глубоких вен или подагру. Причиной перелома
может служить даже незначительная травма.
Поэтому очень важен тщательный сбор
анамнестических данных.
Лечение
нейропатической остеоартропатии
Пациентам с переломами или уже сформировавшимся
суставом Шарко рекомендуют полную разгрузку
пораженной конечности до полной консолидации
костей, а в последующем - ношение индивидуальной
ортопедической обуви. При наличии выраженных
гиперостозов у пациента могут возникать
долгонезаживающие, рецидивирующие язвы. В таких
случаях проводят удаление гиперостозов.
Нейропатические отеки
Накопление жидкости в тканях нижних конечностей,
связанное с нейропатией требует исключения
других причин развития отечности, а именно:
сердечной недостаточности или нефропатии.
Причины возникновения нейропатических отеков
окончательно не выяснены, однако можно
предположить, что они являются следствием
нарушений в вегетативной нервной системе,
образования множества артериовенозных шунтов и
нарушением гидродинамического давления в
микроциркуляторном русле.
Лечение
нейропатических отеков
Наиболее эффективным средством лечения является
назначение симпатомиметиков, например, эфедрина
(30 мг каждые 8 часов). Эфедрин оказывает
достаточно быстрое действие, заключающееся в
уменьшении периферического кровотока и усилении
экскреции натрия. Наряду с периферическим,
эфедрин может оказывать также центральное
регулирующее действие на водно-солевой обмен.
Ишемическая форма синдрома
диабетической стопы
Ишемическая форма характеризуется болевой
симптоматикой, как правило болями в покое. При
этом некоторое облегчение наступает при
изменении положения тела пациентом, например,
при придании возвышенного положения головному
концу койки или свешивании ног с постели. С целью
облегчения болевой симптоматики иногда проводят
люмбальную симпатэктомию, однако при этом какого-либо
улучшения гемодинамики нижних конечностей не
наблюдается.
Внешне кожные покровы стоп
могут быть бледными или цианотичными, или же
иметь розовато-красный оттенок из-за расширения
поверхностных капилляров в ответ на ишемию. В
отличие от нейропатической, при ишемическои
форме поражения стопы холодные. Язвенные дефекты
возникают по типу акральных некрозов (кончики
пальцев, краевая поверхность пяток).
Провоцирующими факторами в плане возникновения
язвенных дефектов являются: ношение тесной обуви,
наличие деформации, отечности стопы. Часто
присоединяется вторичная инфекция как аэробная,
так и анаэробная. Причиной нарушения кровотока
является развитие облитерирующего
атеросклероза артерии нижних конечностей. При
этом имеется четкая тенденция к
генерализованному поражению артерий среднего и
мелкого калибра. У больных сахарным диабетом
атеросклеротические изменения развиваются
гораздо чаще, чем у населения в целом.
Лечение ишемической формы
синдрома диабетической стопы
1. Использование консервативных методов
терапии (см. выше).
2. При неэффективности
проводимой консервативной терапии ставится
вопрос о возможности проведения
реконструктивной хирургической операции. Выбор
метода реконструкции зависит от уровня и вида
поражения:
а) чрескожная транслюминальная
ангиопластика;
б) тромбартерэктомия;
в) дистальное шунтирование веной in situ.
3. Наличие других серьезных
осложнении со стороны сердечно сосудистой
системы, в частности атеросклеротическое
поражение коронарных сосудов, ограничивает
возможности реконструктивной хирургической
операции, направленной на восстановление
нарушенного кровотока в нижних конечностях.
Поэтому у данной категории пациентов во
избежание развития гангрены важно раннее
выявление язвенных поражений и контроль над
инфекцией - назначение адекватной
антибиотикотерапии, местная обработка раневого
дефекта. При наличии отеков нижних конечностей
из-за сердечной недостаточности необходимо
проведение соответствующей дегидратационной
терапии.
Диабетическая гангрена
При обширных гнойно-некротических поражениях
проводится ампутация, при этом наиболее
благоприятными в плане постампутационной
реабилитации являются ампутации на уровне
нижней трети голени. Вопросы постампутационной
реабилитации решаются хирургами-ортопедами.
Важное значение в дальнейшем имеет
протезирование и подбор ортопедической обуви.
Диагностика поражений нижних
конечностей при сахарном диабете
Как было сказано выше, в развитии изменений со
стороны нижних конечностей ведущую роль играют
такие факторы как нейропатия, ишемия, деформация
стопы и наличие отека. При оценке состояния ног
важно определить в каждом конкретном случае
какое место в развитии поражений занимает тот
или иной фактор и в соответствии с этим
определить тактику дальнейшего лечения.
Осмотр и
пальпация стоп и голеней
Является наиболее простым и эффективным методом
выявления поражений стопы. При этом важно
обратить внимание на следующие признаки:
1. цвет конечностей: красный (при
нейропатических отеках или артропатии Шарко)
бледный, цианотичный (при ишемии), розовый в
сочетании с болевой симптоматикой и отсутствием
пульсаций (тяжелая ишемия);
2. деформации: молоткообразные,
крючкообразные пальцы стоп, hallux valgus, hallux varus,
выступающие головки метатарзальных костей стопы,
артропатия Шарко;
3. отеки: двусторонние - нейропатические, как
следствие сердечной или почечной
недостаточности; односторонние - при
инфицированном поражении или артропатии Шарко;
4. состояние ногтей: атрофичные при
неиропатии и ишемии, изменение окраски при
наличии грибкового поражения;
5. гиперкератозы: особенно выражены на
участках стопы, испытывающих избыточное
давление при неиропатии, например, в области
проекции головок метатарзальных костей;
6. язвенные поражения: при нейропатических
формах - на подошве, при ишемических - формируются
в виде акральных некрозов;
7. пульсация: пульсация на тыльной и
заднеберцовой артериях стопы снижена или
отсутствует на обеих конечностях при
ишемеческой форме и нормальная при
нейропатической форме;
8. состояние кожи: сухая истонченная кожа при
нейропатии.
Неврологическое
обследование
1. Исследование вибрационной чувствительности,
которое проводится с использованием
биотезиометра или градуированного камертона (рис.7).
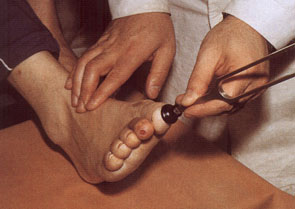
Рис.7 Исследование вибрационной
чувствительности с помощью камертона у больного
сахарным диабетом.
Порог вибрационной
чувствительности повышается с возрастом,
поэтому показатели должны быть сравнены с
номограммной кривой, отражающей изменение
порога вибрационной чувствительности в
зависимости от возраста.
2. Исследование тактильной и
температурной чувствительности.
3. Определение рефлекса
ахиллова сухожилия.
Оценка состояния
артериального кровотока
Для оценки состояния артериального кровотока
производится измерение лодыжечно-плечевого
индекса с использованием допплеровского
аппарата. Измеряется систолическое давление в
артериях ног и плечевой артерии. Соотношение
показателей систолического давления в артериях
нижних конечностей к величине систолического
давления в плечевой артерии и есть лодыжечно-плечевой
индекс. В норме он составляет 1,0 и выше.
Критическими в плане состояния периферического
кровотока считаются показатели индекса ниже 0,6,
прогностически неблагоприятными - случаи, при
которых показатели лодыжечно-плечевого индекса
ниже 0,3.
При наличии обызвествления tunica
media артерий (склероз Менкеберга), который
является одним из проявлений вегетативной
нейропатии, из-за изменения эластичности
сосудистой стенки для ее сдавления необходимо
большее давление в манжете, поэтому можно
получить ложно повышенный лодыжечно-плечевои
индекс. Это явление наблюдается у 10-15% пациентов.
Ангиография артерий нижних
конечностей является наиболее информативным
методом исследования, позволяющим оценить
уровень стеноза или тромбоза, а также его
протяженность.
Профилактика поражений
нижних конечностей при сахарном диабете.
1. Скрининг больных сахарным диабетом в плане
выявления синдрома диабетической стопы
заключается в своевременном выявлении лиц,
имеющих повышенный риск развития язвенных
поражений нижних конечностей. К таким факторам
риска относятся:
- наличие соматической и
автономной нейропатии;
- поражение периферических
сосудов;
- деформация стоп;
- поражения ног в анамнезе;
- ослабление или потеря зрения;
- диабетическая нефропатия,
особенно в терминальной стадии хронической
почечной недостаточности;
- пожилой возраст;
- отсутствие посторонней помощи (проживание
больного отдельно от родных и знакомых);
- избыточное потребление
алкоголя;
- курение.
Поражение нижних конечностей
чаще развивается у мужчин с избыточной массой
тела.
2. Обучение больных.
В настоящее время наиболее эффективной формой
организации специализированной медицинской
помощи больным сахарным диабетом является
организация обучения, которое дает реальную
возможность достижения оптимального контроля
заболевания, как важнейшего фактора
профилактики поздних осложнений.
Структурированные программы обучения содержат
раздел, посвященный правилам правильного ухода
за ногами. Соблюдение этих правил позволяет
значительно снизить риск развития поражения ног.
3. Правильный подбор
повседневной обуви, изготовление и ношение
специальной, ортопедической обуви.
4. Регулярное медицинское
наблюдение за состоянием больного и его нижних
конечностей. Осмотр ног должен проводится каждый
раз во время визита больного диабетом к врачу, но
не реже 1 раза в 6 месяцев.
ДИАБЕТИЧЕСКАЯ МАКРОАНГИОПАТИЯ
Поражение коронарных,
церебральных и периферических сосудов
представляет собой основу макрососудистых
осложнений как при ИЗСД, так и при ИНСД, и во
многом определяет прогноз заболевания.
Ишемическая болезнь сердца (ИБС)
Атеросклероз коронарных сосудов, и как следствие
- ИБС, является ведущей причиной высокой
смертности больных диабетом. Частота развития
ИБС у мужчин, страдающих диабетом, в 2 раза, а у
женщин, больных диабетом, в 3 раза превышает
частоту встречаемости ИБС в общей популяции.
Установлено, что в возрасте от 30 до 55 лет от ИБС
погибает 35% больных диабетом, в то время как в
общей популяции ИБС является причиной смерти
только у 8% мужчин и 4% женщин этой же возрастной
категории. Причина столь высокой встречаемости
склероза коронарных сосудов у больных диабетом
заключается в том, что помимо обычных факторов
риска развития ИБС, общих для всей популяции, при
сахарном диабете имеются дополнительные
специфические неблагоприятные атерогенные
факторы (табл.3).
Таблица 3.
Факторы риска развития ИБС у больных сахарным
диабетом
| Общие для всей популяции |
Специфические для диабета |
1. Артериальная
гипертензия
2. Ожирение
3. Гиперлипидемия
4. Курение
5. Малоподвижный образ жизни
6. Наследственная отягощенность по ИБС |
1. Гипергликемия
2. Гиперинсулинемия
3. Нарушения гемостаза (ускоренное
тромбообразование)
4. Диабетическая нефропатия (микроальбуминурия,
протеинурия) |
Клинические
особенности ИБС у больных сахарным диабетом
1. Одинаковая частота развития ИБС у мужчин и
у женщин.
2. Высокая частота безболевых ("немых")
форм ИБС и инфаркта миокарда, влекущих за собой
высокий риск "внезапной смерти".
3. Высокая частота развития постинфарктных
осложнении: кардиогенного шока, застойной
сердечной недостаточности, нарушений сердечного
ритма.
4. Смертность вследствие перенесенного
острого инфаркта миокарда в течение первой
недели (острая фаза) или первого месяца (фаза
выздоровления) в 2 раза превышает таковую у
больных, не страдающих сахарным диабетом.
Скрининг ИБС
При отсутствии клинической
картины ИБС:
- активно выявлять больных,
имеющих один или несколько факторов риска
развития ИБС (см.табл. 3 - "Факторы риска
развития ИБС");
- обращать внимание на наличие
нетипичных микросимптомов ИБС (неопределенного
дискомфорта, появления одышки и тахикардии при
физическом усилии или на холоде).
Обследование группы риска
включает:
- продолжительную регистрацию
ЭКГ (от 6 до 24 часов) при обычном образе жизни
больного (Холтеровское мониторирование);
- Исследование ЭКГ на фоне
физической нагрузки (на тредмиле или
велоэргометре).
Признаками ишемии миокарда
являются депрессия сегмента ST, нарушения ритма,
систолический шум или симптомы сердечной
недостаточности при мониторировании ЭКГ на фоне
физической нагрузки.
При отсутствии изменений ЭКГ
рекомендуется провести:
- перфузионную сцинтиграфию
миокарда с использованием радиоактивного талия
201 (в покое и после физической нагрузки). При
наличии ишемии миокарда на сцинтиграммах
обнаруживаются дефекты накопления препарата.
При наличии клинической
картины ИБС:
- совместное лечение больного
диабетологом и кардиологом для выбора
оптимальной тактики консервативного лечения;
- консультация кардиохирурга для
решения вопроса о возможности и необходимости
проведения коронароангиографии и оперативного
вмешательства (коронароангиопластики или
шунтирования кровотока).
Профилактика и
лечение ИБС и факторов риска
Рекомендации, касающиеся
образа жизни и диеты:
- прекращение курения;
- регулярные физические
упражнения (индивидуально подобранные, при
обязательном контроле за уровнем метаболических
изменений - физические нагрузки противопоказаны
при кетозе и/или гликемии более 16,7 ммоль/л (300 мг%);
- в диете рекомендуется
относительное расширение углеводного рациона
при сокращении потребления жиров (особенно
насыщенных).
Рекомендации по питанию,
принятые Европейской группой по изучению
сахарного диабета (Consensus, 1993) представлены в
таблице 4.
Таблица 4.
Рекомендуемый состав диеты
| Инградиенты |
Примечания |
Углеводы
- 55-60% |
-преимущественно
нерафинированные;
-добавление растворимых пищевых волокон
(до 30 г/сутки) |
Жиры
- 25-30% |
-ограничение насыщенных жиров
до 10%;
-замещение насыщенных жиров моно- и
полиненасыщенными
(соотношение 1:1:1) |
Белки
- 10-15% |
-при развитии нефропатии
животный белок ограничивают до 0,7 г/кг массы тела |
| Соль |
-при развитии артериальной
гипертензии - ограничивать до 3-6 г/сутки (в
зависимости от тяжести гипертонии) |
| Алкоголь |
-ограничить у больных с
ожирением, гипертонией и гипертриглицеридемией;
-помнить об опасности гипогликемий |
Антиангинальные препараты:
- тактику назначения нитратов
короткого и пролонгированного действия и других
коронарорасширяющих препаратов желательно
согласовать с кардиологом.
Коррекция
гиперлипидемии
Европейская группа по изучению ИНСД разработала
критерии степени компенсации жирового обмена (табл.
5).
Таблица 5.
Критерии компенсации жирового обмена
| Показатели в сыворотке
крови (ммоль/л) |
Компенсация |
| хорошая |
удовлетворительная |
плохая |
| Общий холестерин |
< 5,2 |
5,2 - 6,5 |
> 6,5 |
| Триглицериды |
< 1,7 |
1,7 - 2,2 |
> 2,2 |
| Липопротеины высокой
плотности |
> 1,1 |
0,9 - 1,1 |
< 0,9 |
- контроль за содержанием
липидов сыворотки крови необходимо осуществлять
при первичном обращении к врачу, затем ежегодно -
в случае выявления нормального липидного
спектра крови и 1 раз в 3 месяца при выявлении
гиперлипидемии;
- если при строгом соблюдении
диеты, снижении веса и удовлетворительной
компенсации углеводных нарушений уровень общего
холестерина крови превышает 6,5 ммоль/л, а
триглицеридов - 2,2 ммоль/л, то рекомендуется прием
лекарственных препаратов, нормализующих
липидный спектр крови (никотиновая кислота,
фибраты, ингибиторы гидроксиметилглютариал-коэнзим
А-редуктазы - мевакор, правахол и др.).
- при выраженной гиперлипидемии
следует избегать применения неселективных бета-блокаторов
и тиазидовых диуретиков, поскольку эти препараты
способствуют развитию гиперлипидемии.
Коррекция
артериальной гипертонии
- гипотензивную терапию следует
начинать при повышении уровня АД более 140/85 мм рт.ст.
у лиц моложе 60 лет и при уровне АД более 160/95 мм рт.ст.
у пациентов старше 60 лет;
- выбор оптимального
антигипертензивного препарата должен
производиться с учетом его побочных воздействии
(в частности на углеводный, липидный и
электролитный обмены).
Как следует из клинических и
экспериментальных данных, только ингибиторы
ангиотензин-превращающего фермента (АПФ-ингибиторы)
и антагонисты кальция не оказывают
нежелательного побочного воздействия на
углеводный, липидный и электролитный обмены и,
кроме того, обладают нефропротективным и
кардиопротективным эффектами. Из группы бета-блокаторов
(учитывая их способность блокировать ощущения
нарастающей гипогликемии) предпочтение отдают
кардиоселективным бета-блокаторам (атенолол,
метопролол, талинолол). Из группы диуретиков в
качестве гипотензивных средств рекомендуется
применение петлевых диуретиков (фуросемид,
буфенокс, урегит). Назначение тиазидовых (гипотиазид)
и калийсберегающих диуретиков (верошпирон) при
сахарном диабете не желательно, а при
присоединении почечной недостаточности -
противопоказано.
Эффективные сочетания
антигипертензивных препаратов при стойкой
артериальной гипертензии
|
|
|
эффективная доза
(мг/сутки) |
максимальная доза
(мг/сутки) |
=
|
=> ->
|
ЭНАЛАПРИЛ
или
КАПТОПРИЛ |
10-20 100-150 |
30-40 200-250 |
|
|
ФУРОСЕМИД |
40-320 |
600-800 |
|
-> |
НИФЕДИПИН
или
ВЕРАПАМИЛ |
30-60 240-480 |
100-200
|
| = |
=> |
АТЕНОЛОЛ |
100-200 |
400-600 |
В Эндокринологический Научный
Центр РАМН Вы можете обращаться по всем вопросам
специализированной лечебно-профилактической
помощи больным сахарным диабетом и повышения
квалификации специалистов
117036 Москва, ул.Дм.Ульянова, д.11, ЭНЦ РАМН.
Тел.: 124-58-32, 124-47-44, факс: (095) 310-70-00.
|